大腸がん治療/症状/生存率/余命
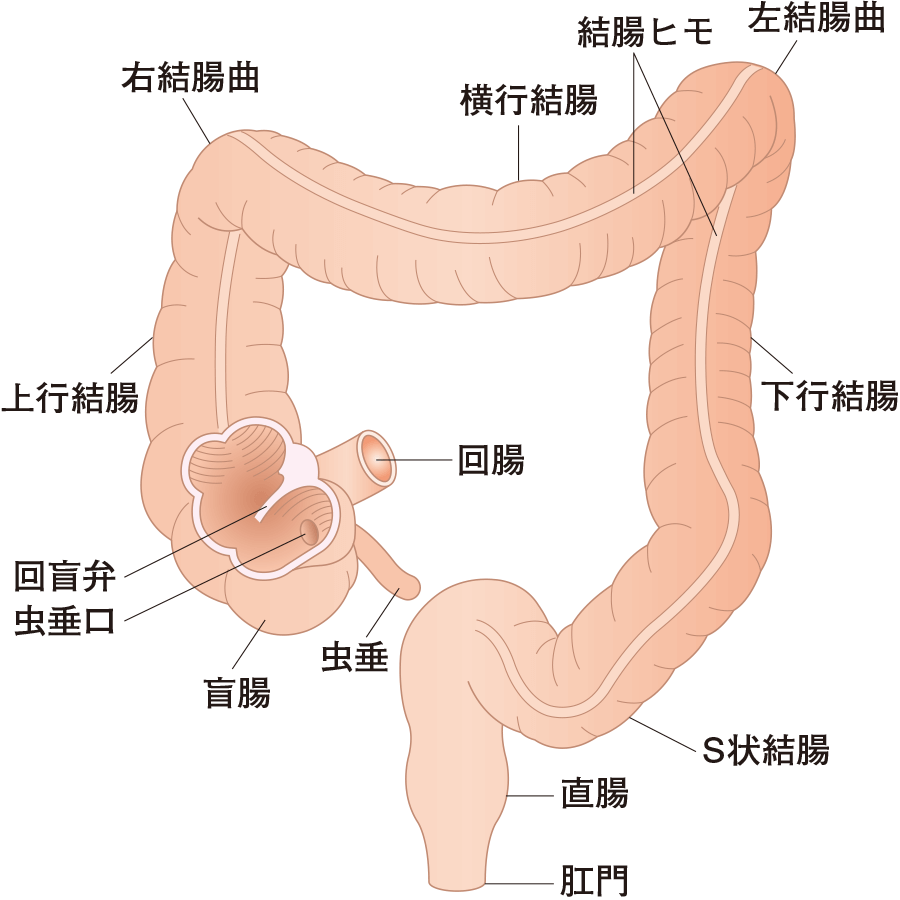
大腸は消化吸収された残りの腸内容物をため、水分を吸収しながら大便にするところです。多種、多量の細菌の住みかでもあります。約2mの長さがあり、結腸と直腸肛門からなります。大腸粘膜のあるところではどこからでもがんができますが、日本人ではS状結腸と直腸が大腸がんのできやすい部位です。
年齢別にみた大腸がん(結腸・直腸・肛門がん)の罹患(りかん)率は、50歳代付近から増加し始め、高齢になるほど高くなります。大腸がんの罹患率、死亡率はともに男性のほうが女性の約2倍と高く、結腸がんより直腸がんにおいて男女差が大きい傾向があります。男女とも罹患数は死亡数の約2倍であり、これは大腸がんの生存率が比較的高いことと関連しています。大腸がんの罹患率の年次推移は、男女とも1990年代前半までは増加し、その後は横ばい傾向です。また、死亡率の年次推移は、男女とも戦後から1990年代半ばまで増加し、その後漸減傾向です。大腸がんの増加には、主として結腸がんの増加が影響しています。罹患率の国際比較では、結腸がんはハワイの日系移民が日本人より高く、欧米白人と同程度であることが知られていましたが、最近では、結腸がん・直腸がんともに、日本人はアメリカの日系移民および欧米白人とほぼ同じになっています。
大腸がんでは、直系の親族に同じ病気の人がいるという家族歴は、リスク要因になります。特に、家族性大腸腺腫症と遺伝性非ポリポーシス性大腸がん家系は、確立した大腸がんのリスク要因とされています。生活習慣では、過体重と肥満で結腸がんリスクが高くなることが確実とされています。また、飲酒や加工肉(ベーコン、ハム、ソーセージなど)は、おそらく確実な大腸がんリスクとされています。国際がん研究機構(IARC)の評価では、喫煙が大腸がんのリスク要因であるとする科学的根拠は、少なからずあるものの、十分とはいえないとされています。日本人を対象にした疫学研究を系統的に総括した論文(2006年)では、喫煙習慣は、日本人では大腸がんリスクを上昇させる可能性があると結論しています。部位別の判定では、直腸がんについては、リスク上昇の可能性がある一方、結腸がんについては不十分と判定されています。そのほか、ヘテロサイクリックアミンやニトロサミンなどが、大腸がんのリスク要因である根拠が、限定的または不十分とされています。
大腸がんの予防要因としては、運動の結腸がん予防効果が確実とされています。また、従来「確実」とされていた野菜については、IARCのレポート(2003年)での新しい評価で、「おそらく確実」と変更されました。その主な理由は、最近発表されたいくつかの大規模なコホート研究の結果、予防的な関連が認められなかったことです。また果物は、同年のIARCレポートでは、大腸がん予防の可能性があるとされています。そのほか、可能性あり、またはエビデンス不十分な予防要因として、葉酸、カルシウム、ビタミンD、食物繊維摂取などが挙げられています。また、非ステロイド消炎鎮痛剤(NSAIDs、アスピリンを含む)とホルモン補充療法が、リスクを減少させる要因として挙げられています。
大腸がんは早い時期に発見すれば、内視鏡的切除や外科療法により完全に治すことができます。少し進んでも手術可能な時期であれば、肝臓や肺へ転移(これを遠隔転移と呼びます)しても、外科療法により完全治癒が望めます。つまり、外科療法が大変効果的です。しかし、発見が遅れれば、肺、肝臓、リンパ節や腹膜などに切除困難な転移がおこります。こうした時期では、手術に加え放射線療法や化学療法(抗がん剤治療)が行われます。
手術を受けた後に再発することもあります。術後は定期的に(4~12ヶ月の間隔)再発チェックのための検査を受ける必要があります。肝臓、肺、腹膜が転移しやすい臓器であり、また、切除した部位に局所再発がおこることもあります。大腸がんは他のがんとは異なり、早い時期に再発が見つかれば、再発巣の切除により完治も期待できます。再発の8割以上は術後3年目以内に発見されます。手術後、5年以上再発しないことが完治の目安です。
大腸がんの自覚症状は、大腸のどこに、どの程度のがんができるかによって違います。大腸のはじまりは盲腸です。頭部、つまり上に向かう部分が上行結腸、次いで横たわっている部位を横行結腸、足つまり下に向かう部分が下行結腸、S字状に曲がっている部分がS状結腸、約15cmの真っすぐな部分が直腸で、最後の肛門括約筋のあるところが肛門管です。国立がんセンター中央病院で1990年~1995年の間に切除された1,409例の大腸がんの発生部位と頻度は、直腸534例(37.9%)、S状結腸483例(34.3%)、上行結腸146例(10.4%)、横行結腸99例(7.0%)、盲腸83例(5.9%)次いで下行結腸64例(4.5%)となっています。
がんに特徴的な症状はなく、良性疾患でもがんと類似した症状がおきます。血便、便が細くなる(便柱細少)、残便感、腹痛、下痢と便秘の繰り返しなど排便に関する症状が多く、これらはS状結腸や直腸に発生したがんにおきやすい症状です。中でも血便の頻度が高く、これはがんの中心が潰瘍となり出血がおきるためです。痔と勘違いして受診が遅れることもありますので注意しましょう。がんによる血便では肛門痛がなく、暗赤色の血液が便に混じったり、ときに黒い血塊が出るなどの特徴があります。肛門から離れた盲腸がんや上行結腸がんでは血便を自覚することは少なく、貧血症状があらわれてはじめて気がつくこともあります。腸の内腔が狭くなりおこる腹痛や腹鳴、腹部膨満感や痛みを伴うしこりが初発症状のこともあります。
ときには、嘔吐などのがんによる腸閉塞症状で発見されたり、肺や肝臓の腫瘤(しゅりゅう)として大腸がんの転移が先に発見されることもあります。こうした症状で発見されるがんは進行したものです。
大腸がんは、早期であればほぼ100%近く完治しますが、一般的には自覚症状はありません。したがって、無症状の時期に発見することが重要となります。大腸がんのスクリーニング(検診)の代表的なものは、地域、職域で普及してきた大便の免疫学的潜血反応で、食事制限なく簡単に受けられる検査です。この検査が陽性でも、「大腸がんがある」ということではありませんし、逆に陰性でも「大腸がんはない」ともいえません。健康な集団の中から、大腸がんの精密検査が必要な人を拾いあげる負担の少ない最も有効な検査法です。最近では、がんセンターで手術を受けた30%近くの方が便潜血反応で発見されています。したがって、40歳を過ぎたらこの検診を受けることをお勧めします。血液検査で腫瘍マーカー(CEA、CA19-9)の異常値で見つかることもあります。
大腸がんの確定診断のためには、大腸内視鏡検査が必須ですが、下剤で便を全部排出しないと精度の高い検査はできません。胃の検査などに比べれば多少負担のかかる検査といえます。以下に大腸がんの患者さんに一般に施行する検査項目に関して概説します。
1)注腸造影検査
食事制限の後、下剤で前処置を十分行います。肛門からバリウムと空気を注入し、X線写真をとります。この検査でがんの正確な位置や大きさ、腸の狭さの程度などがわかります。
2)大腸内視鏡検査
肛門から内視鏡(ビデオスコープ)を挿入して、直腸から盲腸までの全大腸を詳細に調べる検査です。大腸内に便が残っていた場合は十分な検査ができませんので、検査当日に腸管洗浄液を1~2リットル飲んでいただき、大腸内をきれいにしてから検査を行います(80歳以上の方には検査前日からの入院をおすすめしています)。通常、検査は20分程度で終わり、多くの場合大きな苦痛もありませんが、開腹手術後などで腸の癒着している方や、腸の長い方は多少の苦痛が伴います。その場合には軽い鎮静・鎮痛剤を使用することがあります。検査は、まず内視鏡を肛門から一番奥の盲腸まで挿入して、主にスコープを抜いてくる際に十分に観察します。その際、検査を受けている方は、直接モニター画面を見ながら医師の説明を聞くことができます。もし、ポリープ等の病変を認めた場合、悪性か良性かどうかを調べるために病変の一部を採取して、どういう性状の病変かを顕微鏡で調べることもあります(これを組織生検と言います)。また、適応があれば内視鏡的に切除(内視鏡的ポリペクトミーや内視鏡的粘膜切除術(EMR))することも可能です。
3)腫瘍マーカー
血液の検査で身体のどこかに潜んでいるがんを診断する方法です。しかし、大腸がんを早期に発見できる腫瘍マーカーはまだありません。CEAとCA19-9と呼ばれるマーカーが一般的ですが、進行大腸がんであっても約半数が陽性を示すのみです。腫瘍マーカーは転移・再発の指標として、また治療効果の判定基準として用いられています。しかし、転移・再発した場合でも必ずしも異常値を示すわけではなく、逆に転移・再発していない場合でも異常値を示す時もあり、経時的な測定が必要です。
4)画像診断(CT、MRI、超音波検査、PETなど)
これらの検査の進歩は目覚ましいものがありますが、消化管のひとつである大腸にできた病気を発見するには適していません。大腸がんに関しては、原発巣での進みぐあいと肝臓や肺、腹膜、骨盤内の転移・再発を調べるために用いられます。また最近、PET検査が注目されています。骨盤CT、骨盤MRIでも判断できないような骨盤内再発の発見や腫瘍マーカーの推移などから転移・再発が疑われますが、CT、MRI、超音波検査などの通常の検査では転移・再発部位が発見できない場合にPET検査で発見される場合があります。しかし、PETは万能の検査ではありません。また、現時点では医療保険では適応が限られており、通常術前の患者さんに施行することはありません。PET検査の必要性に関しては担当医と十分ご相談下さい。
生存率は、通常、がんの進行度や治療内容別に算出しますが、患者さんの年齢や合併症(糖尿病などがん以外の病気)の有無などの影響も受けます。用いるデータによってこうした他の要素の分布(頻度)が異なるため、生存率の値が異なる可能性があります。
ここにお示しする生存率は、これまでの国立がんセンターのホームページに掲載されていたものです。生存率の値そのものでなく、ある一定の幅(データによって異なりますが±5%とか10%等)をもたせて、大まかな目安としてお考え下さい。
大腸がんと診断がつけば、どの程度のがんか、肝臓、肺などの遠隔臓器に転移があるのかどうかの検査が行われます。がんの拡がりの程度に応じて治療法も異なります。大腸がんには、Dukes(デュークス)分類とTNM分類のステージ分類が使われます。がんの大きさではなく、大腸の壁の中にがんがどの程度深く入っているか、及びリンパ節転移、遠隔転移の有無によって進行度が規定されています。各病期の手術後の5年生存率を括弧内に記載します。
デュークス分類
デュークス A (95%): がんが大腸壁内にとどまるもの
デュークス B (80%): がんが大腸壁を貫くがリンパ節転移のないもの
デュークス C (70%): リンパ節転移のあるもの
デュークス D (10%): 腹膜、肝、肺などへの遠隔転移のあるもの
ステージ分類
0期: がんが粘膜にとどまるもの
I期: がんが大腸壁にとどまるもの
II期: がんが大腸壁を越えているが、隣接臓器におよんでいないもの
III期: リンパ節転移のあるもの
IV期: 腹膜、肝、肺などへの遠隔転移のあるもの
大腸がん治療法には内視鏡的治療、外科療法、放射線療法、化学療法があります。
1)内視鏡的治療
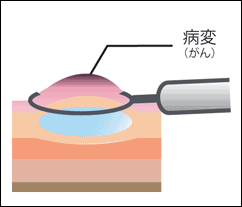
従来の内視鏡でもポリープの有無や性状は診断可能であり、必要に応じてポリープを切除していました。最近では、ポリープの表面構造を100倍まで拡大して観察できる拡大内視鏡を用いることで、より精密な検査が可能となっています。この拡大内視鏡を用いたより精度の高い診断、つまり腫瘍・非腫瘍(内視鏡切除の適応である腫瘍性ポリープと、切除する必要のないその他のポリープ)の鑑別を行っています。また、同様に、拡大内視鏡を用いることで、内視鏡的治療で根治可能な早期がんと外科手術が必要な病変との判別も行っています。なお、ポリープ切除に際しては、大腸粘膜には知覚神経がないため通常痛みを感じることはありません。
(a) 内視鏡的ポリープ切除術(ポリペクトミー)
茎のあるポリープを認めた場合、スコープを通してスネアとよばれるループ状の細いワイヤー(針金)を、茎の部分に引っかけて締めて高周波電流で焼き切ります。
(b) 内視鏡的粘膜切除術(EMR)
無茎性、つまり平坦なポリープや腫瘍の場合は、ワイヤーがかかりにくいため、病変の下層部に生理食塩水などを注入して周辺の粘膜を浮き上がらせ、広い範囲の粘膜を焼き切ります(内視鏡的粘膜切除術)。通常、外来治療を行いますが、病変が大きい場合には短期間の入院の上内視鏡治療を行います。
(c) 内視鏡的粘膜下層剥離術(ESD)
腫瘍が大きい場合、これまでは外科手術か内視鏡的な分割切除(病変を何回かにわけて切除する方法)が選択されていました。しかし最近では、主に胃において行われているESD(内視鏡的粘膜下層剥離術:病変を電気メスで徐々にはぎ取る方法)を応用することにより、大きな腫瘍も一括で切除(一つの塊として切除すること)できるようになってきています(内視鏡的粘膜下層剥離術)。但し、従来のEMRに比較すると高度な手技を要するため切除に多少時間がかかりますし、切除面の傷も広くなるため、数日間の入院が必要となります。
いずれの方法においても、摘出した後、病変を十分に顕微鏡で検索することが重要です。良性の腫瘍や粘膜内にとどまる早期のがん(再発や転移の危険性がない)は内視鏡的に治癒切除することができますが、早期がんの中でもがんがより深く(粘膜筋板を越えて粘膜下層深く)進展していることが判明した場合には、リンパ節転移や再発の危険性が10%前後であるため、追加の外科手術が必要となる場合があります。
2)外科療法
(1)結腸がんの手術
大腸がんの治療は外科療法が基本で、早期がんの場合でも手術が必要になる場合があります。結腸がんの場合、切除する結腸の量が多くても、術後の機能障害はほとんどおこりません。リンパ節郭清(かくせい)と呼ばれるリンパ節の切除とともに結腸切除術が行われます。
(2)直腸がんの手術
直腸は骨盤内の深く狭いところにあり、直腸の周囲には前立腺・膀胱・子宮・卵巣などの泌尿生殖器があります。排便、排尿、性機能など日常生活の上で極めて重要な機能は、骨盤内の自律神経という細い神経繊維によって支配されています。進んでいない直腸がんには、自律神経をすべて完全に温存し、排尿性機能を術前同様に残すことも可能です。しかし、自律神経の近くに進行している直腸がんでは、神経を犠牲にした確実な手術も必要となります。直腸がん手術は、進行度に応じたさまざまな手術法があります。代表的な手術である自律神経温存術、肛門括約筋温存術、局所切除、人工肛門について説明します。
①自律神経温存術
過去15年間に進歩した手術法です。直腸がんの進行の度合いや、排尿機能と性機能を支配する自律神経繊維を手術中に確認し、必要に応じて選択的に自律神経を温存する手術法です。我が国の大腸外科医が世界に誇れる成果です。がんを徹底的に切除しながら、同時に進行度に応じて神経を残す方法です。全部の神経が残せれば、手術前と同様な機能、つまり男性では射精、勃起機能を完全に温存することができます。やや進んだがんでは、勃起機能のみを残す手術法もあります。性機能障害については、国立がんセンターがん対策情報センターHP「性機能障害とリハビリテーション(男性)」の項を参照して下さい。
②肛門括約筋温存術
以前は肛門に近い直腸がんの多くに人工肛門がつくられていましたが、最近では直腸がんの8割は人工肛門を避ける手術ができるようになりました。自動吻合器という筒状の機械を使って、がんの切除後に短くなった直腸端と結腸の先端を縫合し、本来の肛門からの排便を可能にする手術法で肛門括約筋温存術と呼ばれます。肛門から4cm以上、歯状線(肛門と直腸との境界)から2cm以上離れていれば、自然肛門を温存することが可能です。この手術と自律神経温存術を併用すれば、術後の機能障害をかなり軽減することが可能となりました。さらに最近では、歯状線にかかるような、より肛門に近い直腸がんであっても早期がんや一部の進行がんで肛門括約筋を部分的に切除して自然肛門を温存する術式が一部の専門施設で行われるようになってきました。しかし、高齢者の場合、無理に肛門を残すと術後の頻便などのため逆効果になることもあります。したがって、手術法と病期の進行度を正確に説明し、年齢、社会的活動力、本人や家族の希望などを考慮に入れ、総合的に術式を決定することが極めて重要となります。
③局所切除
早期がんや大きな腺腫に採用される手術法です。開腹手術ではなく、肛門からと仙骨近くの皮膚、直腸を切開し病変に到達する方法です。術後に、放射線療法や化学療法を追加する場合もあります。
④人工肛門
肛門に近い直腸がんや肛門にできたがんでは、人工肛門を造設する直腸切断術という手術を行わなければなりません。また、高齢者は肛門括約筋の力が低下しており、無理して括約筋温存術を採用すれば術後の排便コントロールが難しい場合もあるので、人工肛門による排便管理を勧めています。ビデオ、患者会(オストメイト)や専門の看護師を通し、ストーマ教育を充実させ、人工肛門管理の自立とメンタルケアに務めています。
(3)腹腔鏡手術
大腸がんに対する腹腔鏡手術は1990年代前半から国内でも行われるようになり、腹腔鏡手術を施行する施設は徐々に増えてきています。炭酸ガスで腹部を膨らませて、腹腔鏡を腹部の中に入れその画像を見ながら小さな孔から器具を入れて手術を行います。がんを摘出するために1ヶ所、4~8cmくらいの傷が必要です。手術時間は開腹手術より長めですが、小さな傷口で切除が可能ですので、術後の疼痛も少なく、術後7~8日前後で退院できるなど負担の少ない手術です。
がんが盲腸、上行結腸やS状結腸、上部直腸に位置し、内視鏡的治療が困難な大きなポリープや早期がんが腹腔鏡手術のよい対象と考えられています。一部の専門施設ではがんが横行結腸や下行結腸、下部直腸に位置した場合や、進行がんでも腹腔鏡手術が行われています。しかし、進行がんに対しても開腹手術と同等の安全性や治療成績が得られるのかについては今後の検討が必要です。これまでのデータでは、十分に経験を積んだ大腸がんに対する腹腔鏡手術の専門医が担当すれば、進行がんでも腹腔鏡手術の生存率は開腹手術と同等となるのではないかと考えられています。現在、国内では進行がんに対する腹腔鏡手術と開腹手術の臨床比較試験が実施されています。
腹腔鏡手術は近年開発された手術手技であり、特殊な技術・トレーニングを必要とし、外科医のだれもが安全に施行できるわけではありません。現在、腹腔鏡手術の最大の問題は、どこの施設でも安全に腹腔鏡の手術が施行できるわけではないこと、すなわち大腸がんの腹腔鏡手術の専門医が限られていることです。そのため、施設により腹腔鏡手術の対象としている患者さんが異なるのが現状で、大腸がんに対する腹腔鏡手術を導入していない施設も現時点ではたくさんあります。腹腔鏡手術を希望する場合には専門医がいる病院を受診し、開腹手術と比較した長所、短所の説明を十分に受けて、腹腔鏡手術か開腹手術かを決定して下さい。
3)放射線療法
放射線療法には、1)手術が可能な場合での骨盤内からの再発の抑制、手術前の腫瘍サイズの縮小や肛門温存をはかることなどを目的とした手術に対する補助的な放射線療法と 2)切除が困難な場合での骨盤内の腫瘍による痛みや出血などの症状の緩和や延命を目的とする緩和的な放射線療法があります。
(1)補助放射線療法
切除が可能な直腸がんを対象とします。通常、高エネルギーX線を用いて、5~6週間かけて放射線を身体の外から照射します(外部照射)。化学療法の適応がある場合には、化学療法と併用して行われることが標準的です。手術中に腹部の中だけに放射線を照射する術中照射という方法を用いることもあります。我が国における専門施設では十分なリンパ節郭清により、骨盤内からの再発が少ないなど手術成績が欧米に比べ良好なことなどから、現在、我が国では補助放射線療法は欧米に比べ積極的に行われていません。
(2)緩和的放射線療法
骨盤内の腫瘍による痛みや出血などの症状の緩和に放射線療法は効果的です。全身状態や症状の程度によって、2~4週間などの短期間で治療することもあります。また、骨転移による痛み、脳転移による神経症状などを改善する目的でも放射線療法は一般的に行われます。
(3)放射線療法の副作用
放射線療法の副作用は、主には放射線が照射されている部位におこります。そのため治療している部位により副作用は異なります。また副作用には治療期間中のものと、治療が終了してから数ヶ月~数年後におこりうる副作用があります。
治療期間中におこる副作用として、全身倦怠感、嘔気、嘔吐、食欲低下、下痢、肛門痛、頻尿、排尿時痛、皮膚炎、会陰部皮膚炎(粘膜炎)、白血球減少などの症状が出る可能性があります。以上の副作用の程度には個人差があり、ほとんど副作用の出ない人も強めに副作用が出る人もいます。症状が強い場合は症状を和らげる治療をしますが、通常、治療後2~4週で改善します。治療後数ヶ月してからおこりうる副作用として、出血や炎症など腸管や膀胱などに影響が出ることがあります。
4)化学療法
大腸がんの化学療法は、進行がんの手術後に再発予防を目的とした補助化学療法と、根治目的の手術が不可能な進行がんまたは再発がんに対する生存期間の延長及びQOL(クオリティ・オブ・ライフ:生活の質)の向上を目的とした化学療法とがあります。大腸がんに対して有効かつ現時点で国内にて承認されている抗がん剤は、フルオロウラシル(5-FU)+ロイコボリン(国内ではアイソボリン)、イリノテカン(CPT-11)、オキサリプラチン、UFT/LV、UFT、S-1などです。
(1)術後補助化学療法
手術によりがんを切除できた場合でも、リンパ節転移があった場合に、再発率が高くなることが知られています。このような場合、手術を行った後に化学療法を行うことで、再発を予防するあるいは再発までの期間を延長できることがわかっています。このような治療を、術後補助化学療法といいます。一般には、術後補助化学療法の対象はリンパ節転移があるステージIII期の患者さんで、手術後に5-FU/ロイコボリン療法の6ヶ月投与が標準的に行われています。リンパ節転移のないステージI期、ステージII期の大腸がんについて術後補助化学療法の有用性は明らかではないため、基本的には術後補助化学療法は行わず、無治療で経過観察をします。
(2)化学療法
根治的な手術が不可能な場合には、化学療法の適応になります。大腸がんの場合、化学療法のみで完治することはまれですが、臓器機能が保たれている人では、化学療法を行わない場合と比較して、化学療法を行ったほうが、生存期間を延長させることがわかっています。抗がん剤というと、副作用が強く、治療を行ったほうが命を縮めてしまうと考えてしまうかもしれませんが、最近は副作用の比較的少ない抗がん剤の開発と、副作用対策の進歩により、入院せずに外来通院で日常生活を送りながら化学療法を受けている患者さんも多くなりました。大腸がんの化学療法は外来で行えるものも多く、副作用をコントロールしながら、がんあるいは治療と上手につき合っていくことが、一番の目標といえるでしょう。
以下に大腸がん化学療法に用いる代表的な薬と治療法について説明します。
①5-FU(5-フルオロウラシル)+ロイコボリン
5-FUは数十年前より広く使われている薬で、胃がんや食道がんにも用いられています。大腸がんに対しては、ロイコボリンという薬と併用されることが多いですが、最近はそれに加えて後述するイリノテカンやオキサリプラチンとも併用されるケースも多くなってきています。使い方は、週に1回点滴する方法や、2週間に1回持続点滴を行う方法、週に1回肝動脈へ点滴する方法など、いろいろな治療法に組み込まれて使用されています。
副作用は比較的軽微ですが、下痢や口内炎などの粘膜障害や、白血球が減ったりすること、手指の皮膚が黒くなること、食欲の低下などに注意する必要があります。
②イリノテカン
10年ほど前から用いられ、胃がんや肺がんでも広く使用されている薬です。大腸がんに対しては、単独あるいは、5-FU/ロイコボリンとの併用で用いられます。併用する場合には5-FUを短時間(15分)で投与する方法(IFL療法)と、5-FUを短時間で投与した上でさらに46時間持続的に投与する方法(FOLFIRI療法)の2種類あります。以前はIFL療法も多く用いられていましたが、副作用並びに効果の面でFOLFIRI療法のほうが優れていることがわかったため、現在ではFOLFIRI療法が多く用いられるようになってきています。
副作用としては、食欲の低下、全身倦怠感、下痢、白血球が減ったりすること、脱毛などがあります。また投与中の発汗や腸管運動の亢進などもよくみられますが、アトロピンなどの抗コリン薬を用いるとコントロールできることが多いです。食欲の低下に対しては、ステロイド剤や制吐剤を用いますが、コントロールが難しい場合もあります。そのような場合には、担当医に相談しましょう。
③オキサリプラチン
オキサリプラチンは我が国で合成されましたが、主にフランスやアメリカなどで臨床開発が行われ、世界的には大腸がんに対する主な抗がん剤のひとつとなりました。我が国の一般臨床で使用できるようになったのは、2005年4月のことです。単独ではあまり効果を発揮しませんが、5-FU/ロイコボリンとの併用(FOLFOX療法)では、FOLFIRI療法とほぼ同等の治療成績を示しており、この2つの療法が現在の大腸がん化学療法の柱となっています。
副作用としてはイリノテカンと比較して食欲の低下は軽く、脱毛もあまり認めませんが、投与された患者さんの80~90%に感覚性の末梢神経障害をきたすのが特徴です。この末梢神経障害は、寒冷刺激により誘発され、冷たいものを触ったり、冷たい飲み物を飲んだりすることで、手先にびりっとする感覚や、のどの違和感が出現します。治療開始当初は2~3日で消失しますが、治療を継続するにしたがって、回復が遅れ、治療後4~5ヶ月で、10%の患者さんに機能障害(箸が持ちにくくなるなど)をきたすといわれています。このような場合には、オキサリプラチンの投与量を減らしたり、あるいは治療をお休みするなどして副作用の回復を待ちます。これら以外にも白血球が減ったり、血小板が減ったりすることが比較的よくみられます。
④その他
これら以外にも経口剤であるUFT/LV、UFT、S-1なども患者さん自身の状況に応じて使い分けます。また、新しい作用機序を持つ抗体医薬品であるセツキシマブ、ベバシズマブといった、海外で有効性が示された薬も国内で少しでも早く使うことができるように治験が進んでいます。
これらの薬は、必ず使わなくてはいけないというものではなく、状況によってはむしろ使用しないほうが患者さんにとって有益であるケースもあります。例えば、全身状態の悪い患者さんにイリノテカンやオキサリプラチンなどの治療を行った場合、白血球が予想よりも多く減少したりする可能性もありますし、腸の通りが悪い患者さんにはイリノテカンは使用できません。そのような場合には比較的副作用の少ない5-FUを中心に治療を行ったり、がんの苦痛を軽減するための治療(緩和ケア)のみを行うケースもあります。担当医とよく相談して最善の治療方法を選択して下さい。
大腸がんは手術が治療の中心です。少し進行していても治るチャンスが他の消化器がんに比較して高いわけですが、手術後は再発の早期発見のために定期的な検査を行うことが極めて重要です。大腸がんでは肝臓や肺・骨盤内に転移・再発する場合が多いのですが、その場合でも切除可能な場合には早期に転移・再発病変を切除したり、切除不可能な場合にも早期に化学療法や放射線療法を開始することが大切だからです。したがって、手術時の病期により異なりますが、手術後3年間は3~6ヶ月に一度通院し、胸部X線検査、肝臓のCT、超音波検査、腫瘍マーカーなどの検査を行います。厳重に追跡検査を行えば、再発の8割を2年以内に発見することができます。成長の遅い大腸がんもあるので5年間の追跡は必要です。3年目以降は半年に一度の検査で十分です。
出典「国立がんセンターがん対策情報センター」



